نوبل پزشکی یا فیزیولوژی ۲۰۱۶: سازوکار خودخواری
بدست پزشكان گيل • 15 ژانویه 2017 • دسته: تیتر اول٬ ویژه نوبل٬ ویژه نوبل ۲۰۱۶دکتر رقیه حجفروش
برنده جایزه نوبل امسال مکانیسمهای زمینهای اتوفاژی را که یک روند تخریب و بازیافت اجزای سلولی است، کشف کرده و روشن ساخته است. واژه «اتوفاژی» از دو لغت یونانی Auto بهمعنی «خود» و Phagein بهمعنی «خوردن» ساخته شده است و معنی «خودخواری» را به ذهن میآورد.
این مفهوم در دهه ۱۹۶۰ پدیدار شد؛ زمانی که پژوهشگران برای اولین بار مشاهده کردند که سلول میتواند اجزای خود را تخریب کند؛ به این شکل که آنها را در پوستهای محصور کرده، وزیکولهای ساک مانند تشکیل میدهد؛ سپس آنها را به بخشهای بازیافت که لیزوزیم نامیده میشوند، منتقل میکند تا تخریب شوند. سالها اطلاعات کمی درباره این پدیده وجود داشت تا مجموعهای از تجارب درخشان در اوایل دهه ۱۹۹۰ توسط یویشینوری اوسومی انجام گرفت. او از مخمر نان برای شناسایی ژنهای ضروری برای اتوفاژی استفاده کرد؛ سپس در ادامه، مکانیسمهای زمینهای اتوفاژی در مخمر را روشن کرد و تشکیلات پیشرفته مشابه موجود در سلولهای ما را نشان داد.
کشفهای اوسومی منجر شد به ایجاد مدلی جدید در فهم ما از این که چگونه سلول محتویات خود را بازیافت میکند. کشفیات او مسیر فهم اهمیت بنیادین اتوفاژی در بسیاری از روندهای فیزیولوژیک (همانند سازگاری با گرسنگی یا پاسخ به عفونت) را گشود. جهش در ژنهای اتوفاژی میتواند سبب بیماری شود و روند اتوفاژی در برخی شرایط، از جمله سرطان یا بیماریهای نورولوژیک، نقش دارد.
تخریب، عملکردی اساسی در بسیاری از سلولهای زنده
در اواسط دهه ۱۹۵۰ دانشمندان یک قسمت جدید تخصصیافته در سلول مشاهده کردند و آن را «ارگانل» (اندامک) نامیدند که حاوی آنزیمهایی بود که پروتئین، کربوهیدرات و چربیها را هضم میکرد. این بخش که اکنون «لیزوزیم» نامیده میشود، کارگاه تخریب محتویات سلولی است. دانشمند بلژیکی کریستین دیدوو (Christian de Duve) بهپاس کشف لیزوزیم، برنده نوبل پزشکی یا فیزیولوژی در سال ۱۹۷۴ شد. مشاهدات جدید در دهه ۱۹۶۰ نشان داد که بخش زیادی از محتویات سلول میتواند داخل یک لیزوزیم یافت شود؛ بنابراین آشکار شد که سلول راهبردی برای انتقال محمولههای بزرگ به لیزوزیم دارد. تحلیلهای بیوشیمیایی و میکروسکوپی بیشتر، یک نوع جدید حمل و نقل «سلولی- وزیکولی» بار به لیزوزیمها برای تخریب را آشکار کرد (تصویر ۱). دیدوو کلمه اتوفاژی یا خودخواری را برای توصیف این روند ابداع کرد و وزیکولهای جدید «اتوفاگوزوم» نامیده شدند.
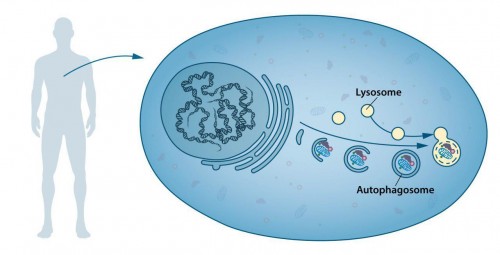
تصویر ۱. اتوفاگوزوم: سلولهای ما بخشهای تخصصیافته مختلفی دارند. لیزوزیم یکی از این بخشها را تشکیل میدهد و حاوی آنزیمهایی برای هضم اجزای سلولی است. یک نوع جدید وزیکول که اتوفاگوزوم نامیده میشود، داخل سلول مشاهده شده است. وقتی اتوفاگوزوم شکل میگیرد، اجزای سلولی مثل پروتئینهای خرابشده یا ارگانل را میبلعد؛ سپس به لیزوزیم ملحق شده و آنجا محتویات آن، به بخشهای کوچکتر تشکیلدهندهشان تجزیه میشود. این روند مواد مغذی برای سلول و قطعات ساختمانی برای ترمیم مجدد تولید میکند.
طی دهههای ۱۹۷۰ و ۱۹۸۰ پژوهشگران بر سیستم دیگری متمرکز شدند که برای تخریب پروتئینها استفاده میشد، یعنی «پروتئازوم». در پی این تحقیقات سه دانشمند جایزه نوبل شیمی سال ۲۰۰۴ را برای کشف تخریب پروتئین با واسطه «یوبیکوئیتین» دریافت کردند؛ پروتئازومی که بهطور موثری پروتئینها را یکبهیک تخریب میکرد. اما مکانیسم این را که چگونه سلول از دست مجموعههای پروتئینی بزرگتر خلاص میشود و با یک اندامک کهنه و فرسوده چه میکند، توضیح نمیداد. آیا روند اتوفاژی میتوانست پاسخ این سوال را بدهد و اگر چنین است با چه مکانیسمی؟
یک آزمایش پیشرو
اوسومی در حوزههای مختلفی از پژوهش فعال بود اما بهمحض آغاز فعالیت در آزمایشگاه خود در سال ۱۹۸۸، تلاشش را بر تخریب پروتئینها در واکوئولها، اندامکی که معادل همان لیزوزوم در سلولهای انسانی است، متمرکز کرد. سلولهای مخمر برای مطالعه نسبتاً سادهتر بودند و بههمین دلیل غالباً بهعنوان مدلی برای سلولهای انسانی مورد استفاده قرار میگرفتند.
مخمرها بهویژه برای شناسایی ژنهایی که در مجموعه مسیرهای سلولی مهم هستند، مفیدند. اما اوسومی با یک چالش بزرگ روبهرو شد؛ سلولهای مخمر کوچک بودند و ساختمانهای درونی آنها بهآسانی در زیر میکروسکوپ تشخیص داده نمیشد؛ بنابراین او مطمئن نبود که آیا اتوفاژی اصلاً در این ارگانیسم وجود دارد یا خیر. وی استدلال کرد که اگر بتواند روند تخریب در واکوئولها را زمانی که پروسه اتوفاژی فعال باشد قطع کند، آنگاه اتوفاگوزومها باید در داخل واکوئول جمع شده، زیر میکروسکوپ قابل دیدن شوند. بنابراین مخمرهای جهشیافتهای کشت داد که فاقد آنزیمهای تخریب واکوئولی بودند و همزمان اتوفاژی را با گرسنه نگه داشتن سلولها تحریک کرد. نتایج مجابکننده بود! در طول چند ساعت واکوئولها با وزیکولهای کوچکی که تخریب نشده بودند، پر شد (تصویر ۲). وزیکولها اتوفاگوروم بودند و آزمایش اوسومی ثابت کرد که اتوفاژی در سلولهای مخمر وجود دارد. اما حتی از این مهمتر، این بود که او حالا روشی داشت تا ژنهای کلیدی درگیر در این روند را شناسایی و مشخص کند. این کار یک پیشرفت غیرمنتظره بود و اوسومی آن را در سال ۱۹۹۲ منتشر کرد.
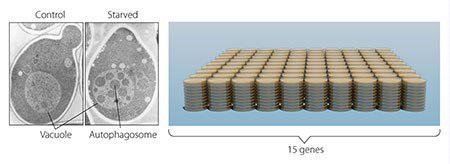
تصویر ۲. مخمر: در مخمر (سمت چپ) بخش بزرگی وجود دارد که واکوئول نامیده میشود و معادل لیزوزوم در سلولهای پستانداران است. اوسومی مخمرهای فاقد آنزیمهای تخریبکننده واکوئولی ایجاد کرد. وقتی این سلولهای مخمر، گرسنه نگه داشته شدند، اتوفاگوزومها بهسرعت داخل واکوئولها تجمع پیدا میکرد (قطعه میانی). آزمایش او نشان داد که اتوفاژی در مخمر وجود دارد. بهعنوان قدم بعدی، اوسومی هزاران مخمر جهشیافته (سمت راست) را مطالعه و ۱۵ ژن ضروری برای اتوفاژی را شناسایی کرد.
ژنهای اتوفاژی کشف شدند
اوسومی سپس فواید گونههای مخمر مهندسی شده خود را که در آن اتوفاگوزومها در زمان گرسنگی تجمع پیدا میکردند، بهدست آورد؛ وقتی ژنهای مهم اتوفاژی غیرفعال شده باشد، این تجمعات نباید رخ دهد. اوسومی سلولهای مخمر را در معرض مواد شیمیایی که بهطور تصادفی موتاسیونهایی در ژنها ایجاد میکرد، گذاشت و سپس اتوفاژی را القا کرد. روش او جواب داد! در طول یک سال پس از کشف اتوفاژی در مخمر، او اولین ژنهای ضروری اتوفاژی را یافت. در سری بعدی مطالعات پربار اوسومی، پروتئینهای کدشده توسط این ژنها عملاً مشخص شد. نتایج نشان داد که اتوفاژی توس
ط آبشاری از پروتئینها و مجموعههای پروتئینی که هر کدام مرحله مشخصی از ابتدا تا تشکیل اتوفاگوزومها را تنظیم میکنند، صورت میگیرد (تصویر ۳).
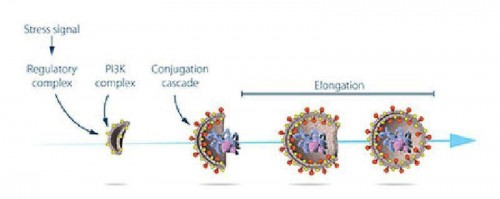
تصویر ۳. مراحل تشکیل اتوفاگوزوم: اوسومی کارکرد پروتئینهایی را که توسط ژنهای کلیدی اتوفاژی کددار شده بودند، مطالعه کرد. او نشان داد که چگونه استرس سبب آغاز اتوفاژی میشود و با چه مکانیسمی پروتئینها و مجموعههای پروتئینی مراحل مجزای تشکیل اتوفاگوزوم را پیش میبرند.
اتوفاژی، مکانیسمی ضروری در سلولهای ما
پس از شناسایی دستگاه اتوفاژی در مخمر، یک پرسش کلیدی باقی ماند؛ آیا مکانیسم معادلی برای کنترل این روند در سایر ارگانیسمها وجود دارد؟ بهزودی آشکار شد که حقیقتاً مکانیسمهای یکسانی در سلولهای ما کار میکند. ابزارهای پژوهشی مورد نیاز برای تحقیق در اهمیت اتوفاژی در انسانها امروزه در دسترس هستند.
با سپاس از اوسومی و سایر دنبالکنندگان گامهای او، امروزه میدانیم که اتوفاژی کارکردهای مهم فیزیولوژیک را در جایی که اجزای سلولی نیاز به تخریب و بازیافت دارند، کنترل میکند. اتوفاژی بهسرعت میتواند برای انرژی سلول، سوخت و برای تجدید اجزای سلولی، قطعات ساختمانی فراهم آورد؛ بنابراین برای پاسخ سلول به گرسنگی و سایر انواع استرس ضروری است. پس از عفونت، اتوفاژی میتواند باکتریها و ویروسهای مهاجم داخل سلول را پاک کند. اتوفاژی در نمو جنین و تفکیک و تبدیل سلولی نقش دارد. سلولها همچنین از اتوفاژی برای پاکسازی پروتئینهای تخریب شده و اندامکها و نیز مکانیسم کنترل کیفیت که برای تداخل با عوارض منفی پیری حیاتی است، استفاده میکنند.
اختلال در اتوفاژی به بیماری پارکینسون، دیابت نوع دوم و سایر اختلالاتی که در پیری رخ میدهد، ربط داده شده است. جهش در ژنهای اتوفاژی میتواند منجر به بیماری ژنتیکی شود. اختلال در دستگاه اتوفاژی به سرطان نیز مرتبط است. در حال حاضر تحقیقات جدی برای ساختن داروهایی که بتواند اتوفاژی را در بیماریهای مختلف هدف قرار دارد، ادامه دارد.
مدت ۵۰ سال است که اتوفاژی شناخته شده اما اهمیت اساسی آن در فیزیولوژی و پزشکی فقط پس از تحقیقات تغییر مدل یوشینوری اوسومی در سالهای دهه ۱۹۹۰ شناخته شد. بنابراین نوبل فیزیولوژی یا پزشکی امسال به او اهدا شد.
یوشینوری اوسومی در سال ۱۹۴۵ در فوکواوکای ژاپن متولد شد. او Ph.D خود را از دانشگاه توکیو دریافت کرد و پس از گذراندن سه سال در دانشگاه راکفلر نیویورک در امریکا، به دانشگاه توکیو بازگشت و از سال ۱۹۸۸گروه تحقیقاتی خود را بنیان گذاشت. او از سال ۲۰۰۹ تاکنون استاد موسسه فنآوری توکیو است.
کمیته نوبل که جایزه نوبل در فیزیولوژی یا پزشکی را به او اهدا میکند، متشکل از ۵۰ پروفسور در موسسه کارولینسکا است.
Ref: nobelprize.org/nobel_prizes/medicine/laureates/2016/press.html
دکتر رقیه حجفروش
پزشک عمومی
Email: dr.hajf@gmail.com
۳ اکتبر ۲۰۱۶
مجمع نوبل موسسه کارولینسکا امروز تصمیم گرفته است جایزه نوبل فیزیولوژی یا پزشکی سال ۲۰۱۵ را تقدیم کند به:
یوشینوری اوسومی (Yoshinori Ohsumi)
بهپاس کشف مکانیسمهای اتوفاژی.

یوشینوری اوسومی متولد ۱۹۴۵، فوکواوکا، ژاپن؛ محل اشتغال در زمان اهدای جایزه: موسسه فنآوری توکیو، ژاپن

پزشكان گيل
فرستادن نامه به این نویسنده | همهی نوشتههای پزشكان گيل
